Saludo estimados estudiantes en el día de hoy trabajaremos la tabla periódica.
También realiza comprobaciones acerca de cómo cambia la estructura de los elementos cuando estos son sometidos a distintas reacciones de carácter químico, y también el como es posible que se conviertan en otros elementos.
La química posee dentro de sí un gran número de ramificaciones y divisiones dedicadas a estudiar distintos campos o ámbitos como lo puede ser el estudio de la materia orgánica y la inorgánica, así como también la química analítica y la bioquímica.
La tabla periódica y su estructura
¿Qué es la tabla periódica?
La tabla periódica está ordenada por el número de átomos, protones, propiedades químicas y electrones de un elemento dado, de forma tal que muestra la estructura y composición del elemento.
La tabla periódica se ejecuta por la ley periódica, estableciendo las propiedades químicas y físicas de los elementos que la integran.
Es la base para estudiantes de las áreas de medicina, ingeniería y química. Además de que es vital conocer cómo funciona, ya que algunos elementos son utilizados por el ciudadano común.
Los elementos de la tabla periódica se clasifican en familias, también llamados «Grupos», porque las tres categorías principales de los elementos (metales, no metales y metaloides) son demasiado amplias.
En la tabla periódica de elementos, hay siete filas horizontales de elementos llamados «Períodos».
Las columnas verticales de elementos son lo que se denominan grupos o «Familias».
Familias de la Tabla Periódica
Nombres de los Elementos y Número Atómico
Aquí tienes todos los nombres de los elementos, y su número atómico (el numerito que hay en cada cuadrado arriba del símbolo) también llamado Z.
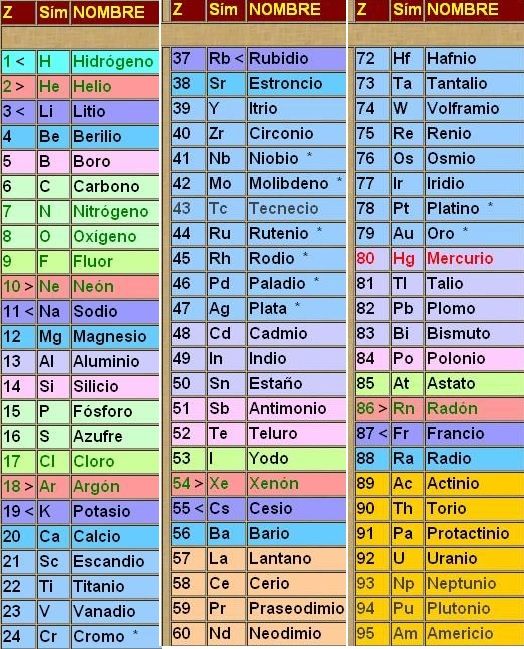
La familia IA tiene 1 electrón de valencia; la IIA tiene 2 electrones de valencia; la familia VIIA tiene 7 electrones de valencia; y la VIII A tiene 8 electrones de valencia.
Así que para las familias marcadas con un número romano y una A, el número romano da el número de electrones de valencia.
El número romano hace que sea muy fácil de determinar que el oxígeno (O) tiene seis electrones de valencia (que es en la familia VIA), que el silicio (Si) tiene cuatro, y así sucesivamente.
Como ves en la tabla de arriba de la columna 3 a la 12 las familias se nombran por el nombre del primer elemento de la columna y se llaman metales de transición.
Características de las Familias de la Tabla Periódica
Las características de los elementos de cada familia está determinada principalmente por el número de electrones en la capa externa de energía o última capa, también llamados electrones de valencia.
Estos son los electrones que van a reaccionar cuando el elemento se une con otro.
Si quieres saber más sobre estos electrones te recomendamos el siguiente enlace: Configuraciones Electrónicas.
Veamos las características concretas de cada familia.
La familia IA se compone de los metales alcalinos.
En las reacciones, estos elementos todos tienden a perder un solo electrón.
Esta familia contiene algunos elementos importantes, tales como el sodio (Na) y potasio (K).
Ambos de estos elementos juegan un papel importante en la química del cuerpo y se encuentran comúnmente en sales.
Se llaman así porque cuando reaccionan con el agua forman el álcali. No entra en este grupo el Hidrógeno.
La familia IIA se compone de los metales de tierras alcalinas.
Todos estos elementos tienden a perder dos electrones.
El calcio (Ca) es un miembro importante de la familia IIA (que necesita calcio para los huesos y dientes sanos).
La familia IIIA ninguno muestra tendencia a formar aniones simples.
Tienen estado de oxidación +3, pero también +1 en varios elementos.
El boro se diferencia del resto de los elementos del grupo porque es un metaloide, mientras que los demás van aumentando su carácter metálico conforme se desciende en el grupo.
Debido a esto, puede formar enlaces covalentes bien definidos, es un semiconductor, es duro a diferencia del resto que son muy blandos.
Tienen puntos de fusión muy bajos, a excepción del boro.
La familia IVA son los carbonoideos, no metales.
A medida que se desciende en el grupo, aumenta el carácter metálico de sus componentes.
el C y el Si son no metales, el germanio es un semimetal y el Sn junto con el Pb son netamente metálicos.
El C y el Si tienden a formar uniones covalentes para completar su octeto electrónico, mientras que el Sn y el Pb tienden a ceder, por su carácter metálico.
La familia VA son los no metales nitrogenoideos.
El N y el P son no metálicos, el arsénico y el antimonio son semimetales, a veces se comportan como metales y otras como no metales (esto es carácter anfótero).
El Bi es un metal. esta variación de no metálico a metálico, a medida que se avanza en el grupo, se debe al aumento del tamaño de los átomos.
Resulta más difícil separar un electrón del átomo de N que hacerlo con el de Bi, porque en el primero la atracción nuclear es más intensa.
Las moléculas de N son biatómicas, el P, As, Sb presentan moléculas tetratómicas en algunos de sus estados alotrópicos.
El Bi es biatómico. todos estos elementos forman enlaces covalentes.
La familia VIA son los no metales calcógenos.
Sus puntos de fusión, densidad y ebullición aumentan a medida que se desciende en el grupo, es decir a medida que aumenta el tamaño de los átomos.
Se combinan con el H para formar hidruros no metálicos.
De acuerdo a la electronegatividad, la afinidad química con el H decrece del O al Te. Cuando se combinan con el H, su número de oxidación de -2, pero cuando lo hacen con elementos más electronegativos presentan numero de oxidación positivo (4 , 6)
La familia VIIA se compone de los halógenos.
Todos ellos tienden a ganar un solo electrón en las reacciones.
Miembros importantes de la familia incluyen el cloro (Cl), que se utiliza en la fabricación de la sal de mesa y cloro, y el yodo (I).
La familia VIIIA se compone de los gases nobles.
Estos elementos son muy reactivos.
Durante mucho tiempo, los gases nobles fueron llamados los gases inertes, porque la gente pensaba que estos elementos no reaccionarían en absoluto con ningún otro elemento.
Un científico llamado Neil Bartlett mostró que al menos algunos de los gases inertes si puede reaccionar, pero requiere condiciones muy especiales.
Después del descubrimiento de Bartlett.
Metales, Lantánidos y Actínidos
Metales de Transición: El mayor grupo de elementos en la tabla periódica, que van de los Grupos del 3 al 12.
Tienen diferentes grados de reactividad y una muy amplia gama de propiedades.
En general, sin embargo, los metales de transición son buenos conductores del calor y la electricidad y tienen altos puntos de ebullición y densidades.
Lantánidos: son un grupo de metales situados en la segunda fila de la parte inferior de la tabla periódica.
Son bastante raros, sus números atómicos oscilan entre 57 (lantano) a 71 (lutecio).
Algunos de estos elementos se pueden encontrar en los superconductores, la producción de vidrio, o láser.
Actínidos: Son un grupo de metales en la última fila de la tabla periódica.
La familia de los actínidos contiene quince elementos que comienzan con el actinio.
Todos los actínidos son radiactivos y algunos no se encuentran en la naturaleza.
En general, sin embargo, los metales de transición son buenos conductores del calor y la electricidad y tienen altos puntos de ebullición y densidades.
Lantánidos: son un grupo de metales situados en la segunda fila de la parte inferior de la tabla periódica.
Son bastante raros, sus números atómicos oscilan entre 57 (lantano) a 71 (lutecio).
Algunos de estos elementos se pueden encontrar en los superconductores, la producción de vidrio, o láser.
Actínidos: Son un grupo de metales en la última fila de la tabla periódica.
La familia de los actínidos contiene quince elementos que comienzan con el actinio.
Todos los actínidos son radiactivos y algunos no se encuentran en la naturaleza.
videos a consulta:
Número Atómico
Este número es colocado en la parte izquierda (como un subíndice) del símbolo del elemento que le corresponde. Por ejemplo en el elemento hidrógeno todos sus átomos tienen un protón, por lo tanto su Z también es 1.
Es importante recordar que los átomos presentes en los distintos elementos, cuentan con diferentes sumas de protones y electrones. Un átomo al encontrarse en estado natural tiende a ser neutro, por lo tanto tendrá una cantidad igual de protones y electrones. Por ejemplo, el magnesio tiene el número atómico 12, esto quiere decir que el átomo que lo compone posee 12 protones y 12 electrones.
El número atómico, por lo tanto, vine a determinar las características químicas de un elemento y es por este motivo que dicho elemento puede ser descrito como permanente en cualquier combinación de átomos que presenten un número atómico dado.
Cabe agregar, que la distribución que presenta en la actualidad la tabla periódica, fue llevada a cabo por el químico de origen ruso Dimitri Mendeleiev ya que fue éste quien organizó estos elementos, apoyándose en la variación de las características químicas. Mientras que el químico alemán Julius Lothar Meyer se dio a la tarea de organizar los elementos basándose en las características físicas de los átomos. A este último, se le considera la autoría de la tabla periódica.
¿Qué es la Configuración Electrónica?
Recordemos que los orbitales son las regiones alrededor del núcleo de un átomo donde hay mayor probabilidad de encontrar los electrones.
¿Cómo se escribe la Configuración Electrónica?
Recordemos que existen 7 niveles de energía: 1, 2, 3, 4, 5, 6 y 7. Y cada uno de ellos tiene, a su vez, hasta 4 subniveles de energía denominados s, p, d y f.
Así, el nivel 1 contiene solamente al subnivel s; el nivel 2 contiene subniveles s y p; el nivel 3 contiene subniveles s, p y d; y los niveles 4 a 7 contienen subniveles s, p, d y f.
¿Cuál es la cantidad máxima de electrones que puede alojar cada subnivel?
El subnivel s aloja un máximo de 2 electrones.
El subnivel p aloja un máximo de 6 electrones.
El subnivel d aloja un máximo de 10 electrones.
El subnivel f aloja un máximo de 14 electrones
¿Cómo se utiliza el Diagrama de Moeller o Regla de las Diagonales?
El diagrama de Moeller o Regla de las diagonales se utiliza para recordar el orden de llenado de los orbitales atómicos. Es, simplemente, una regla mnemotécnica.

Es la siguiente:
La forma de construir este diagrama es escribir los niveles de energía atómicos (del 1 al 7) y los correspondientes subniveles a su lado. Luego se trazan líneas diagonales desde arriba hacia abajo.
No debes recordarlo de memoria, ahora ya sabes construirlo, de modo que el día del examen, lo puedes escribir y luego utilizar para resolver los ejercicios.
¿Cómo se utiliza el Diagrama de Moeller o Regla de las Diagonales?
Para utilizar la regla de las diagonales simplemente debes seguir las líneas diagonales del diagrama desde arriba hacia abajo. Eso marcará el orden de llenado de los subniveles de energía. La cantidad de electrones se escribe como superíndice. Una vez que un subnivel de energía está "completo" de electrones se pasa al subnivel siguiente
Ejemplos de Configuración Electrónica
PASO 1: Lo primero que debemos conocer es el Número Atómico (Z) del elemento en cuestión, en este caso, el Manganeso el cual nos indica la cantidad de protones.
Al tratarse de un átomo neutro, la cantidad de protones será igual a la cantidad de electrones.
PASO 2: El siguiente paso será ubicar la totalidad de los electrones en los orbitales correspondientes utilizando la Regla de las Diagonales.
Veamos: El Manganeso (Mn) tiene un número atómico Z=25, es decir, que tiene 25 protones y 25 electrones.
Siguiendo la Regla de las Diagonales escribimos la configuración electrónica (CE) del Mn de la siguiente manera:

El átomo de Carbono tiene un número atómico (Z) de 6. Es decir, tiene 6 protones en su núcleo. Al tratarse de un átomo neutro tiene también 6 electrones alrededor del núcleo, distribuidos en distintos niveles y subniveles de energía. Utilizando la regla de las diagonales o Diagrama de Moeller escribimos la Configuración Electrónica (CE) del Carbono:

Configuración Electrónica del Hidrógeno (H)
El átomo de Hidrógeno tiene un número atómico (Z) de 1.
Es decir, tiene 1 protón en su núcleo. Al tratarse de un átomo neutro tiene también 1 electrón alrededor del núcleo.
Utilizando la regla de las diagonales o Diagrama de Moeller escribimos la Configuración Electrónica (CE) del Hidrógeno:





Comentarios
Publicar un comentario